Tira Dúvidas
Carbono - É possível transformar grafite em diamante?
12 de Maio de 2021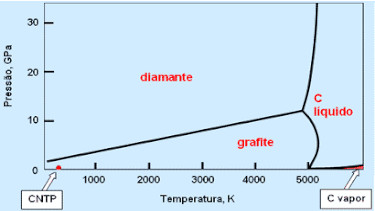
Por Júlio C. de Carvalho
UOL
O carbono é um dos elementos conhecidos há mais tempo - o seu nome vem do latim carbo, que significa carvão. Na Terra, o carbono é o 14º elemento mais abundante, sendo essencial à vida como a conhecemos. Devido às propriedades únicas do carbono - especialmente a capacidade de formar fortes ligações carbono-carbono - há milhões de compostos conhecidos contendo esse elemento. Suas substâncias simples (os alótropos do carbono) são, porém, bem menos numerosas.
No grafite e no diamante
Sendo o carbono relativamente abundante, talvez fosse de se esperar que o diamante, um dos alótropos do carbono, fosse mais comum. No entanto, deve-se levar em conta a estabilidade de uma substância. Nas condições ambientais, o grafite é a forma preferida do carbono. Uma pena? Bom, talvez, se o diamante fosse abundante e o grafite não, teríamos um sem número de objetos e instrumentos contendo diamantes, enquanto o grafite seria caríssimo.
Na verdade, o grafite apresenta propriedades tão fascinantes quanto às do diamante, e que são exploradas em objetos tão diversos quanto lápis, lubrificantes, contatos de motores e eletrodos de fornos.
Propriedades são resultado da estrutura molecular
As marcadas diferenças entre o grafite e o diamante são devidas às suas estruturas moleculares diversas: ambos são materiais cristalinos feitos de uma rede com bilhões de átomos de carbono, mas a semelhança acaba aí.
As características mais interessantes dessas substâncias são o alto ponto de fusão do grafite e a altíssima condutividade térmica do diamante (muito superior à de metais como o cobre e o ouro).
Por que o grafite conduz corrente elétrica e o diamante não? E por que a situação se inverte, quando se trata de condução de calor? A resposta está nas ligações: o grafite possui uma rede de duplas ligações conjugadas que permitem a migração de elétrons, enquanto o diamante não possui. Já o diamante, tendo uma estrutura com poucas falhas e muito bem "amarrada", conduz a energia cinética - expressa pelo calor - com uma velocidade muito alta.
Transformando grafite em diamante
Ora, já que o diamante não é abundante, será que é possível fabricá-lo? Sim, é possível - e isso é feito comercialmente, mas não para diamantes de joalheria.
Na verdade, a conversão de grafite em diamante exige um pouquinho de energia (o ΔH da reação é de meros 0,45kcal/mol), mas as condições de transformação são bem difíceis de manter: algo em torno de 50000 atm a 800o C, para uma transformação lenta, ou temperaturas e pressões ainda mais altas, para transformações rápidas.
A ilustração a seguir é um diagrama de fases (parecido com o que se estuda para água e gelo, por exemplo). Note que uma pressão de 1 GPa (gigapascal) é equivalente a mais ou menos 10000 atmosferas.
Há prensas que permitem fazer diamantes grandes, geralmente a alto custo (embora alguns catalisadores permitam acelerar o processo, mas isso é um segredo bem guardado). Por outro lado, olhando o cantinho direito do diagrama de fases, você pode notar que é possível obter carbono vaporizado a pressões relativamente baixas. Ora, e se alguém tentasse fazer diamante a partir do carbono gasoso, a pressões muito baixas?
A resposta é: conseguiria películas finas e muito resistentes, em uma técnica conhecida como CVD (em inglês, deposição química de vapor). Fascinante, não?.

Por Júlio C. de Carvalho
UOL
O carbono é um dos elementos conhecidos há mais tempo - o seu nome vem do latim carbo, que significa carvão. Na Terra, o carbono é o 14º elemento mais abundante, sendo essencial à vida como a conhecemos. Devido às propriedades únicas do carbono - especialmente a capacidade de formar fortes ligações carbono-carbono - há milhões de compostos conhecidos contendo esse elemento. Suas substâncias simples (os alótropos do carbono) são, porém, bem menos numerosas.
No grafite e no diamante
Sendo o carbono relativamente abundante, talvez fosse de se esperar que o diamante, um dos alótropos do carbono, fosse mais comum. No entanto, deve-se levar em conta a estabilidade de uma substância. Nas condições ambientais, o grafite é a forma preferida do carbono. Uma pena? Bom, talvez, se o diamante fosse abundante e o grafite não, teríamos um sem número de objetos e instrumentos contendo diamantes, enquanto o grafite seria caríssimo.
Na verdade, o grafite apresenta propriedades tão fascinantes quanto às do diamante, e que são exploradas em objetos tão diversos quanto lápis, lubrificantes, contatos de motores e eletrodos de fornos.
Propriedades são resultado da estrutura molecular
As marcadas diferenças entre o grafite e o diamante são devidas às suas estruturas moleculares diversas: ambos são materiais cristalinos feitos de uma rede com bilhões de átomos de carbono, mas a semelhança acaba aí.
As características mais interessantes dessas substâncias são o alto ponto de fusão do grafite e a altíssima condutividade térmica do diamante (muito superior à de metais como o cobre e o ouro).
Por que o grafite conduz corrente elétrica e o diamante não? E por que a situação se inverte, quando se trata de condução de calor? A resposta está nas ligações: o grafite possui uma rede de duplas ligações conjugadas que permitem a migração de elétrons, enquanto o diamante não possui. Já o diamante, tendo uma estrutura com poucas falhas e muito bem "amarrada", conduz a energia cinética - expressa pelo calor - com uma velocidade muito alta.
Transformando grafite em diamante
Ora, já que o diamante não é abundante, será que é possível fabricá-lo? Sim, é possível - e isso é feito comercialmente, mas não para diamantes de joalheria.
Na verdade, a conversão de grafite em diamante exige um pouquinho de energia (o ΔH da reação é de meros 0,45kcal/mol), mas as condições de transformação são bem difíceis de manter: algo em torno de 50000 atm a 800o C, para uma transformação lenta, ou temperaturas e pressões ainda mais altas, para transformações rápidas.
A ilustração a seguir é um diagrama de fases (parecido com o que se estuda para água e gelo, por exemplo). Note que uma pressão de 1 GPa (gigapascal) é equivalente a mais ou menos 10000 atmosferas.
Há prensas que permitem fazer diamantes grandes, geralmente a alto custo (embora alguns catalisadores permitam acelerar o processo, mas isso é um segredo bem guardado). Por outro lado, olhando o cantinho direito do diagrama de fases, você pode notar que é possível obter carbono vaporizado a pressões relativamente baixas. Ora, e se alguém tentasse fazer diamante a partir do carbono gasoso, a pressões muito baixas?
A resposta é: conseguiria películas finas e muito resistentes, em uma técnica conhecida como CVD (em inglês, deposição química de vapor). Fascinante, não?.